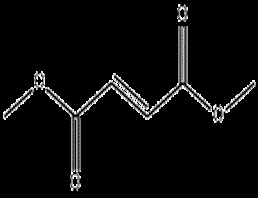
经典创新案例:富马酸二甲酯的传奇和专利纠葛
发布日期:2020/11/1 10:00:37
结构简单,机制不明的富马酸二甲酯,如今已给渤健累计带来了250亿美元的收入,新药前沿在本文详细介绍该产品的开发历程和上市后的专利纠葛,希望给国内企业在创新方面提供新的思路,并在知识产权保护方面汲取经验。
在新药研发的历史上,提到富马酸二甲酯,可能更多的业内人士会非常感慨:
这种以前常用的化工原料,结构简单,而且作为药物开发上市后治疗作用机制不明的产品,如今已给渤健(Biogen Idec)累计带来了250亿美元的收入,占到该公司总收入的40%,并且该产品仍在为渤健继续带来丰厚的收益。
富马酸二甲酯开发史
富马酸二甲酯的医学用途,其实早在上世纪50年代,德国和瑞典的医生就开始使用富马酸酯外敷到皮肤上来治疗银屑病,但这些应用仅仅是根据医生的经验,并且只能通过配方药师来制成复方膏剂。直到一家瑞士药企富玛法姆股份公司(Fumapharm AG)开始根据这些经验开发银屑病药物,最终富马酸二甲酯才进入临床实践。
总部位于瑞士卢塞恩私有制药公司富玛法姆股份公司成立于1983年,致力于为医疗需求未得到满足的患者开发源自富马酸酯的疗法。在与渤健合作之前,富玛法姆有两种产品:在德国已上市用于治疗银屑病的商业产品FUMADERM®和处于临床阶段产品BG-12(富马酸二甲酯)。
FUMADERM®肠溶片
FUMADERM®是含有富马酸酯的口服肠溶片,于1994年在德国获得批准,用于治疗中度至重度寻常型银屑病。该产品是一种混合物,活性成分包括:
富马酸二甲酯
富马酸氢乙酯、钙盐(2:1)
富马酸氢乙酯、镁盐(2:1)
富马酸氢乙酯、锌盐(2:1)
2003年10月,渤健从富玛法姆获得了BG-12世界范围内独家专有权,以开发和销售该款具有免疫调节作用机制的口服富马酸酯衍生物。渤健和富玛法姆对BG-12在包括多发性硬化症(MS)和银屑病在内的多种疾病中的作用进行着研究。
2006年5月31日,渤健和富玛法姆宣布,两家公司已经签署了关于渤健以2.2亿美元收购富玛法姆的最终协议。渤健从而获得了后者上市产品FUMADERM®,以及继续开发BG-12。
关于协议
根据收购协议,渤健每完成相关产品(FUMADERM®和Tecfidera®)10亿美元累计销售额,就要支付富玛法姆3亿美元,直到总销售额累计达到200亿美元为止。目前仅Tecfidera®销售额就远远超过200亿美元。
2011年,渤健宣布了DEFINE和CONFIRM这两项全球性,安慰剂对照的3期临床试验的阳性数据,该试验评估了240 mg BG-12,为期两年,每天两次或每天三次治疗多发性硬化症。研究表明BG-12治疗后多发性硬化症疾病活动次数显著减少,同时具有良好的安全性和耐受性。
2012年2月28日,渤健宣布已向美国食品药品管理局(FDA)提交BG-12新药上市申请(NDA)。
2012年5月9日,渤健宣布美国FDA和欧盟监管机构欧洲药品管理局(EMA)已接受BG-12用于治疗多发性硬化症的上市申请。
2012年10月18日,渤健宣布,FDA将BG-12处方药用户收费法案(PDUFA)的初始审核日期延长3个月,属于标准的延长期限。
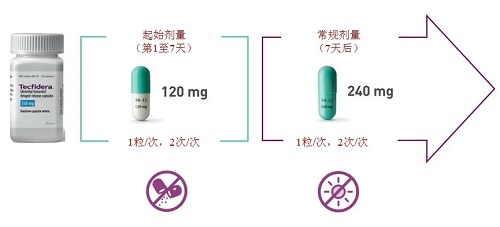
2013年3月27日,FDA批准BG-12上市,商品名为Tecfidera®,规格为120mg、240mg,剂型为缓释胶囊(Delayed-Release Capsules),内容物为速释片(simple immediate release tablet)。
Tecfidera®
适应症:用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征、复发缓解性疾病、活动性继发进展性疾病。
用法用量:口服,起始剂量为120mg,2次/天。7天后,剂量应增加至维持剂量240mg,2次/天。
整粒吞服,不要将胶囊内容物压碎,咀嚼或撒在食物上。
可随食物或不随食物服用。
作用机制:富马酸二甲酯(DMF)在多发性硬化症中发挥治疗作用的机制尚不清楚(unknown)。DMF和代谢物富马酸单甲酯(MMF)在动物和人体内和体外激活核因子相关因子2(NRF2)途径。Nrf2通路参与细胞对氧化应激的反应。MMF已被确定为体外的烟酸受体激动剂。
2014年1月30日Tecfidera®获EMA批准,规格为120mg、240mg,剂型为肠溶胶囊(gastro-resistant hard capsules),内容物为肠溶微片(enteric-coated microtablets)。
2016年12月19日Tecfidera®在日本获得批准,日文商品名为テクフィデラ®,规格为120mg、240mg,剂型为胶囊(カプセル/capsules),内容物为白色至灰白色微片(白色~灰白色のマイクロ錠)。
2020年2月15日,富马酸二甲酯肠溶胶囊在我国提交上市申请,目前正在审评中。
Tecfidera®一上市就有不俗表现,2013年销售额就达到了8.76亿美元,2019年增长到44.33亿美元。在过去5年里,该产品的每年销售金额就占到渤健公司当年总收入的40%左右。
专利保护:攻防拉锯战
对于新药,专利保护无疑是开发者获取产品上市后利益化的常规和有效手段。作为Tecfidera®活性成分富马酸二甲酯,尽管化合物在结构上缺乏“新颖性”不能受到专利保护,但作为原研公司的渤健和富玛法姆仍对其进行了一系列的专利布局来争取获得更长的市场垄断时间。
从Tecfidera®获批上市之时期,渤健获得该药物在欧美地区的多项专利保护,不过如今,已有部分专利陆续到期。值得一提的是,2008年2月,渤健申请了一系列剂量专利,并且分别在美国(US8399514)和欧洲(EP2137537)获得授权,进而对富马酸单甲酯、富马酸二甲酯或其组合来治疗多发性硬化症,而活性成分剂量为480mg/day(口服),从而把Tecfidera®的专利保护期延长到了2028年。

如果故事到此,对于渤健来说无疑是最完美的结局,然而——
Forward Pharma的出现彻底打乱了渤健的美梦。从Forward Pharma公司网站中的介绍(About us)就可以知道两家公司的纠葛:
Forward Pharma A/S是一家丹麦生物制药公司,于2005年开始开发DMF的专有配方,用于治疗炎症和神经系统疾病。公司通过许可协议向渤健授予了其所有IP的不可撤销的许可,并于2017年2月从渤健收到了不可退还的现金费用12.5亿美元,并于2017年9月通过减资向股东返还9.177亿欧元。Forward Pharma公司有机会从渤健获得Tecfidera®或其他DMF产品在美国以外用于多发性硬化症的净销售额的特许权使用费,其中包括在欧洲,关于EP2801355专利异议程序的有利结果,包括对此的任何上诉。
然而,就是Forward Pharma公司的EP2801355专利,对富马酸二甲酯一个剂量/剂型保护(480mg/day口服),让渤健为此付出了沉重的代价。
2017年1月,签订了Biogen Swiss Manufacturing GmbH,Biogen International Holding Ltd.,Forward Pharma和某些关联方之间的和解和许可协议,该协议自2017年2月1日起生效。渤健获得了Forward Pharma与Tecfidera®相关知识产权的全球许可。作为交换,渤健向Forward Pharma支付了12.5亿美元的现金。不过2家公司针对EP2801355专利在欧美继续进行着博弈。
在美国:2017年3月,美国专利商标局(USPTO)对该知识产权纠纷做出了有利于渤健的裁决。Forward Pharma向美国联邦巡回上诉法院提起上诉。美国联邦巡回上诉法院维持了美国专利商标局2017年3月的裁决,并于2019年1月驳回Forward Pharma的复审请求书。
在欧盟:2018年3月,欧洲专利局(EPO)撤销了Forward Pharma的欧洲专利EP2801355。Forward Pharma已向EPO上诉技术委员会(TBA)提出上诉,并将于2020年6月18日举行听证会。但是,由于新型冠状病毒2019(COVID-19)大流行,听证会可能会延迟。
在中国专利布局:富玛法姆股份公司1999年提交了用途专利CN99812388.9(驳回)及分案申请CN200410011769.X(专利期满)。此外,该药物多项制剂专利申请正在实审中:CN201380018792.9,CN201680047251.2(富马酸二甲酯颗粒和其药物组合物),CN201580073821.0,CN201580073821.0,CN201780016727.0(包含富马酸二甲酯的药物珠粒制剂)。
当渤健与Forward Pharma正在对EP2801355专利进行着拉锯战式博弈之时。渤健公司自己的US8399514专利在美国遭遇到了仿制药企业的挑战。仿制药巨头迈兰(Mylan)便是最为积极挑战者之一。
2019年2月,迈兰对US8399514项专利提出了跨部门审查(IPR)挑战。如果挑战成功,Tecfidera®仿制药最早就会在2021年上市,这对于原研产品在美国的销售金额将会是致命一击。
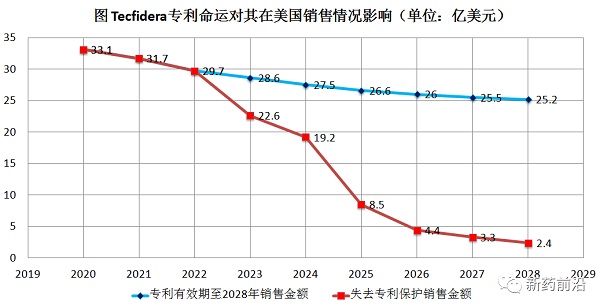
2020年2月5日,美国专利复审委员会(PTAB)就迈兰针对Tecfidera®的US8399514专利提出的无效请求做出了裁决,裁决认定迈兰无法证明US8399514专利权利要求1-20的不可专利性,维持US8399514专利权有效。此项裁决对于渤健无疑是个重大胜利,渤健终于可以暂时松一口气了。
然而,围绕着Tecfidera®专利的纠葛以及对未来产品升级换代的综合考虑,渤健和Alkermes公司合作开发的Vumerity®(diroximel fumarate,富马酸地昔洛韦)于2019年10月29日获得FDA批准上市。富马酸地昔洛韦是一种口服富马酸盐的前体,在体内会迅速转化为富马酸单甲酯,即富马酸二甲酯的相同活性代谢产物。Vumerity®在试验的主要终点上表现显著优于Tecfidera®,且严重胃肠道副作用明显减少。不过从上市来,2019年第四季度和今年季度,Vumerity®的销售金额仅为500万美元和200万美元。
正如咨询公司IDEA Pharma的首席执行官Mike Rea先生所言:“医药公司的成功不但需要发现和开发有意义的候选药物(发明),还需要将它们成功推向市场,带给患者(创新)。”【发明和创新:阿斯利康和罗氏各占榜首】富马酸二甲酯的故事无疑是新药开发历史中最成功的“创新”案例之一。当寻找新化合物难度越来越大,而生物药开发成本越来越高之时,富马酸二甲酯的开发无疑为我们新药开发提供了新的思路。与此同时,对于旧化合物的新用途/剂型开发的专利保护无疑是新的挑战。
欢迎您浏览更多关于富马酸二甲酯的相关新闻资讯信息
- 富马酸二甲酯 2024/03/19
- 富马酸二甲酯的用途与合成 2022/10/17
- 富马酸二甲酯的作用机制 2021/09/22
- Biogen富马酸二甲酯在华获批上市,2020年全球销售额38.41亿美元 2021/07/09
- 市场 | 渤健富马酸二甲酯获批 国内MS口服药物市场或将再起波澜 2021/05/20
1of3