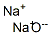-
定義
本品は、ナトリウムの酸化物であり、次の化学式で表される。
-
性質
酸化ナトリウムの融点は1,132℃で、分解する温度は1,950℃です。400℃以上に加熱すると、酸化ナトリウムは分解して過酸化ナトリウム (Na2O2) とナトリウム (Na) になります。
岩石の風化作用の際には、大気中の二酸化炭素が水に溶けることで、岩石中に含まれている長石中の酸化ナトリウムが反応し、炭酸水素ナトリウムに変わります。また、酸化ナトリウムは、二酸化炭素を吸収すると炭酸ナトリウムになります。
酸化ナトリウムは吸湿性です。そのため、酸化ナトリウムを水へ溶かすと、水と激しく化学反応して、水酸化ナトリウムに変わります。酸化ナトリウムを空気中で加熱した場合には、過酸化ナトリウムになります。
-
解説
Na2O(61.98).ナトリウムと酸素を180 ℃ 以下で加熱するか,またはアジ化ナトリウムと硝酸ナトリウムを真空中で加熱して得られる.白色の粉末.密度2.27 g cm-3.400 ℃ 以上に加熱すると分解してNa2O2とNaとになる.ナトリウムと酸素を180 ℃ 以下で加熱するか,またはアジ化ナトリウムと硝酸ナトリウムを真空中で加熱して得られる.白色の粉末.密度2.27 g cm-3.400 ℃ 以上に加熱すると分解してNa2O2とNaとになる.吸湿性があり,水に溶かすとはげしく反応して水酸化ナトリウムを生じる.二酸化炭素を吸収して炭酸ナトリウムとなる.森北出版「化学辞典(第2版)
-
用途
酸化ナトリウムは,吸湿性で,水と激しく反応して水酸化ナトリウムを生ずる。また二酸化炭素を吸収して炭酸ナトリウムになる。ガラス・セラミックス・ゼオライトの原料,脱水剤,重合剤,縮合剤などに用いられる.
-
構造
酸化ナトリウムは、ナトリウムの酸化物である無機化合物です。酸化ナトリウムの化学式はNa2O、モル質量は61.979で、密度は2.27g/cm3です。
酸化ナトリウムの結晶は、立方晶系に属する白色結晶です。逆蛍石型構造であり、フッ化カルシウムにおけるフッ化物イオンの位置にナトリウムイオンが、カルシウムイオンの位置に酸化物イオンが、それぞれ配置しています。また酸化ナトリウムの格子定数は、a = 5.55Åです。
-
化粧品の成分用途
pH調整剤
-
化学的特性
white to grey granules or powder
-
使用
Sodium oxide is used in chemical manufacturing, ceramics and glasses. Ethylbenzene dehydrogenation and carbon dioxide shift-reaction occurs using a sodium oxide/alumina catalyst. It is employed as catalyzing gasification of CO2 on carbon.
-
定義
A white solid formed by burning
sodium in a deficiency of oxygen or alternatively by reducing sodium peroxide or
sodium hydroxide with the requisite
amount of sodium. It reacts violently with
water to form sodium hydroxide and with
acids to form solutions of their salts.
Sodium monoxide forms cubic crystals. It
dissolves in liquid ammonia to give a mixture of sodamide and sodium hydroxide.
-
一般的な説明
Sodium oxide is a strong alkaline oxide, commonly used as an active flux in ceramic glazes.
-
生成
酸化ナトリウムは、適量の酸素とナトリウムを混ぜて、化学反応によって生成可能です。過剰の空気中でナトリウムを加熱した場合には、酸化ナトリウムだけでなく、約20%の過酸化ナトリウムも生成します。
比較的純度が良い酸化ナトリウムを得るためには、300℃でナトリウムと水酸化ナトリウムを化学反応させて、未反応のナトリウムを蒸留を用いて取り除くことで得ることが可能です。
さらに、液体のナトリウムとの化学反応によっても、窒素とともに酸化ナトリウムが生成します。
-
他のナトリウム酸化物
ナトリウムの酸化物の組成には、酸化ナトリウム (Na2O) 以外にも、過酸化物イオン (O22- を含む過酸化ナトリウム (Na2O2) や超酸化ナトリウム (NaO2) があります。
例えば、過酸化ナトリウム (Na2O2 は、過酸化ソーダとも呼ばれ、黄白色の粒状または粉末状の物質です。過酸化ナトリウムは酸化力が強く、水と激しく反応することで、過酸化水素と水酸化ナトリウムに分解します。そのため、過酸化ナトリウムは、過酸化水素の製造原料でもあります。
それに対して、超酸化ナトリウム (NaO2) は、ナトリウムの超酸化物です。過酸化ナトリウムと酸素を高温高圧下で反応することで得られます。もしくは、ナトリウムのアンモニア溶液と酸素の反応によっても、超酸化ナトリウムを得ることが可能です。
超酸化ナトリウムは容易に加水分解して、過酸化ナトリウムと水酸化ナトリウムの混合物になります。
参考文献
-
使用用途
酸化ナトリウムは通常、水と反応させた水酸化ナトリウムの状態で使用されることが多いです。水酸化ナトリウムは、苛性ナトリウムとも呼ばれ、化学繊維、紙、パルプ、化学薬品、食品工業、石鹸など幅広い用途に使用されています。
その他にも、酸化ナトリウムはを吸収してに変化したり、空気中で加熱することでに変化します。酸化ナトリウム単体の状態では、様々な化合物の材料として使用される場合が多いです。
-
参考文献
E. Zintl, H.H.v. Baumbach, Z. Anorg. Allg. Chem., 198, 88 (1931), DOI: 10.1002/zaac.19311980109.