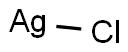-
外観
白色~わずかにうすい灰紫色又はわずかにうすい褐色, 粉末及び小塊
-
性質
塩化銀は、銀と塩素からなる無機化合物で、常温常圧では白色の結晶性固体です。AgClで表され、モル質量は143.32g/mol、密度5.56g/cm³です。
水にほとんど溶けませんが、アンモニア水、チオシアン酸カリウム、シアン化カリウムなどの化合物には、より溶解性が高くなります。酸に対して安定で、酸には溶解しませんが、塩基には溶けやすいです。また、還元剤やチオシアン酸イオンと反応して、銀やその他の化合物を生成することがあります。
塩化銀は光に感応する性質を持ち、紫外線や可視光線に曝されると黒色の銀に還元されます。この特性から、古典的な写真フィルムや感光材料に使用されています。
-
定義
本品は、銀の塩化物であり、次の化学式で表される。
-
溶解性
天然には角銀鉱として存在する。可溶性の銀塩水溶液に塩化物を加えると沈殿する白色固体。融点455℃,沸点1550℃。結晶構造は岩塩型で,塩化ナトリウムと同じである。融解すると橙色になる。水に対する溶解度1.55mg/lH2O(20℃)。塩酸溶液では[AgCl2]-を生成して溶解度が増大する。またアンモニア水,チオ硫酸ナトリウム,シアン化カリウムの溶液にも,それぞれ錯イオンをつくって溶ける。
-
溶解性
エタノール、希酸に不溶。水に難溶。アンモニア水、シアン化アルカリ、チオ硫酸ナトリウムなどの水溶液および塩酸には錯イオンとなって溶ける。アンモニア水、シアン化カリウム溶液及びチオ硫酸ナトリウム溶液に溶け、水及び酸類にほとんど溶けない。
-
解説
普通は AgCl をさす。無色の粉末で光に当てると黒変する。比重 5.56,融点 455℃,沸点 1550℃。水に難溶で,溶解度は 10℃で 0.8mg/l ,100℃で 21.7mg/l 。しかし,濃塩酸,アンモニア水にはそれぞれ錯イオン [AgCl2]- ,[Ag(NH3)2]+ をつくって溶ける。またシアン化アルカリ,チオ硫酸塩,炭酸アンモニウムの溶液にも類似の反応で溶ける。写真乳剤,銀メッキ,防腐剤に使われる。
ブリタニカ国際大百科事典 小項目事典 ブリタニカ
-
解説
AgCl(143.32).塩化銀, 天然には角銀鉱として産出する.硝酸銀の水溶液に塩化物イオンを含む水溶液を加えると,白色の沈殿として得られる.塩化ナトリウム型構造.融点455 ℃,沸点1550 ℃.密度5.56 g cm-3.溶融すると黄色の液体となり,冷却すると透明な固体となる.光伝導性がある.水にほとんど不溶.25 ℃ の飽和水溶液1.93 mg L-1.エタノール,希酸に不溶.濃塩酸,飽和塩化物水溶液には [AgCl2]- としてわずかに溶ける.アンモニア水,チオ硫酸ナトリウムおよびシアン化物水溶液に,それぞれ錯イオン [Ag(NH3)2]+,[Ag(S2O3)2]3-,[Ag(CN)2]- になって溶ける.感光性を有するので写真,測光に利用される.そのほか,銀めっき,銀-塩化銀電極,スクリーン印刷,インキ,銀電池,医療にも用いられる.
-
用途
塩化銀電極、メッキ材料。
-
構造
塩化銀は、銀イオンと塩素イオンからなる無機化合物で、1:1 の化学量論比で銀と塩素が結合したイオン性化合物です。塩化銀の結晶構造は面心立方格子構造を取ります。
その結晶構造では、各銀イオンは周囲の6つの塩素イオンに囲まれており、逆に各塩素イオンも周囲の6つの銀イオンに囲まれています。このように、銀イオンと塩素イオンが互いに八面体形状で配位しているため、結晶構造全体は非常に規則的で安定しています。
また、このイオン性結晶構造のために塩化銀は絶縁体であり、高い融点 (455℃) を持ち、水にほとんど溶けない性質を持っています。
-
化学的特性
Silver chloride, AgCl, is a white,granular powder that darkens on exposure to light,finally turning black.It exists in several modifications differing in behavior toward light and solubility in various solvents. Soluble in ammonium hydroxide, concentrated sulfuric acid, and sodium thiosulfate and potassium bromide solutions, very slightly soluble in water, can be melted, cast, and fabricated like a metal. Derived by heating a silver nitrate solution and adding hydrochloric acid or salt solution. The whole is boiled, then filtered. This must take place in the dark or under a ruby-red light. Used in photography,photometry and optics, batteries, photochromic glass,silver plating,production of pure silver, and as an antiseptic. Single crystals are used for infrared absorption cells and lens elements and as a lab reagent
-
使用
Employed in Silver plating. Owing to its characteristic of reversible reduction to silver metal, it is used in photochromic lenses. Used as a cathode in sea water activated batteries. In electrochemistry, silver chloride electrode is used for potentiometric measurements. It serves as an antidote for mercury poisoning, and eliminates mercury from body. It is used in glass manufacturing industry. It is useful in the production of bandages, wound healing products and inglaze lustre, personal deodorant products, as well as for long term preservation of drinking water in water tanks; its pharmaceutical composition finds use as an antibacterial agent.
-
主な応用
?AgCl is very important as a linear polarizer in the infrared region (λ: 2–23 mm). The refractive index is almost constant in the infrared region and the polarization angle is almost independent of wavelength. The polarization angles are 63°43' (3 mm), 63°20' (10 mm), and 63°33' (20 mm), showing the difference of angle below 18 for λ: 2–23 mm. The polariscope is fabricated typically by arranging the six sheets of plates with the thickness of 0.5 mm in the shape of roof type. Bakelite or plastic is good for the material of the holder case.
-
定義
T3DB: Silver chloride is a chloride of silver that occurs naturally as the mineral chlorargyrite. It is used to make photographic paper and pottery glazes. It is also found in stained glass colorants, bandages, and other wound healing products, and may be used as an antidote to mercury poisoning. Silver is a metallic element with the chemical symbol Ag and atomic number 47. It occurs naturally in its pure, free form, as an alloy with gold and other metals, and in minerals such as argentite and chlorargyrite.
-
危険性
As for silver.
-
化学性质
融点455℃,沸点1560℃,光によって黒紫色になる
-
使用用途
塩化銀は光に敏感な性質を持ち、紫外線や可視光線に曝されると黒色の銀に還元されます。この特性から、古典的な写真フィルムや感光材料、写真用紙などの製造に利用されています。
塩化銀は、銀塩化銀電極と呼ばれる基準電極に使用されています。安定性と再現性が良く、広く使われている電極です。生体分子を識別し測定することが出来るにも使われています。
また、塩化銀は水にほとんど溶けませんが、アンモニアやチオシアン酸イオンなどの化合物には溶解性が高くなります。この性質を利用し、銀イオンの検出や定量分析、沈殿滴定法に使用されます。
そのほか、有機化学反応における触媒や、ガラスやセラミックスの製造の分散剤、水処理における消毒剤や藻類の増殖抑制剤として利用されます。これらの用途以外にも、塩化銀はさまざまな分野で利用されており、その特性が幅広く活用されています。
-
概要
塩化銀とは、銀と塩素からなる無機化合物です。
通常、塩化銀 (I) (silver(I) chloride、化学式: AgCl) のことを指します。常温常圧では、白色の結晶性固体です。
の水溶液に、のような塩化物イオンを含む水溶液を加えると、白色の沈殿として得られます。水やなどの溶媒にはほとんど溶けませんが、濃塩酸、アンモニア水等には良く溶けます。
-
製造方法
塩化銀はいくつかの方法で製造することができます。主な製造方法は、以下のとおりです。
1. 二次反応法
二次反応法は、銀の塩と塩化物イオンを含む化合物を混ぜ合わせることにより、塩化銀が沈殿する方法です。例えば、硝酸銀と塩化ナトリウムの水溶液を混ぜると、以下の化学反応が起こります。
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
この反応によって生成された沈殿物 (AgCl) をろ過や遠心分離によって分離し、さらに乾燥して純粋な塩化銀を得ることができます。
2. 電解法
電解法は、電気分解によって銀と塩素を生成し、その後、銀と塩素を直接反応させて塩化銀を得る方法です。まず、塩素および銀を生成するために、塩化ナトリウム溶液などを電気分解します。次に、生成された銀と塩素を適切な条件下で反応させることにより、塩化銀を得ます。
3. 銀の直接塩素化
この方法では、金属銀を直接塩素ガスと反応させて塩化銀を生成します。反応は以下のように表されます。
2Ag(s) + Cl2(g) → 2AgCl(s)
この反応は、高温下で行われることが一般的です。生成された塩化銀は、冷却とろ過によって回収されます。これらの方法のほかにも、さまざまな合成法が存在することがありますが、最も一般的なのは二次反応法です。
-
合成方法
硝酸銀水溶液に塩化物溶液を加える
-
純化方法
Recrystallise it from conc NH3 solution by acidifying with HCl, filtering off the solid, washing it with H2O and drying it in a vacuum. It is soluble in NH3 and should be kept in the dark.
-
参考文献
H.E. Swanson, R.K. Fuyat, G.M. Ugrinic, National Bureau of Standards (U.S.), Circular, 539, 1 (1955) .